Omuz çevresi tümörlerde ters omuz protezi
Omuz çevresi tümörlerde ters omuz protezi
Reverse shoulder prosthesis for tumors around the shoulder
Volkan Gürkan1 , Muzaffer Ağır2 , Fatih Yıldız3 1 Avicenna Umut Hastanesi, Ortopedi ve Travmatoloji Kliniği, İstanbul 2 Acıbadem Üniversitesi Tıp Fakültesi, Ortopedi ve Travmatoloji Ana Bilim Dalı, İstanbul 3 Bezmialem Vakıf Üniversitesi, Tıp Fakültesi Ortopedi ve Travmatoloji Ana Bilim Dalı, İstanbul
Proksimal humerus hem primer hem de sekonder malignitelerin sık görüldüğü bir bölgedir. Bununla beraber dinamik ve statik stabilizatörlerin bir arada çalıştığı, instabiliteye yatkın bir eklemdir. Dolayısıyla kemik ve yumuşak doku rezeksiyonu gerektiren büyük kitleler sonrasında fonksiyonel bir omuz elde etmenin teknik zorlukları bulunmaktadır. Geçmişten günümüze çeşitli cerrahi prosedürler denenmekle beraber son yıllarda rezeksiyondan sonra anatomik mega endoprotezler ile rekonstrüksiyon neredeyse bir rutin hâlini almıştır. Ancak protezin fonksiyonel olarak çalışması için gereken kas yapılarının kitleyle beraber çıkarılması gerektiği durumlarda bu protezler birer yer kaplayıcı işlevi görmekte ve hastaların fonksiyonel sonuçları kötü olabilmektedir. Yaşlı hastalardaki rotator manşet artropatilerinde rutin olarak uygulanan ters omuz protezinin getirmiş olduğu biyomekanik avantajlar, onkolojik cerrahiler sonrasında kullanımını da son dönemlerde yaygınlaştırmıştır.
Onkolojik omuz cerrahilerindeki kullanımı henüz yeni olan ve uzun dönem sonuçlarının yetersiz olduğu ters omuz protezinin hangi endikasyonlarda kullanılması gerektiği veya kontrendikasyonları ile alakalı fikir birliği henüz bulunmamaktadır. Bu derlemede proksimal humerus kitleleri sonrasında ters omuz protezinin kullanım alanları, cerrahide dikkat edilmesi gereken noktalar ve diğer rekonstrüksiyon seçenekleriyle karşılaştırılması gibi konular literatür bilgilerinin ışığında ele alınacaktır. Anahtar sözcükler: omuz; ters omuz protezi; tümör; rekonstrüksiyon
The proximal humerus is a region where both primary and secondary malignancies are common. However, it is a joint prone to instability where dynamic and static stabilizers work together. Therefore, obtaining a functional shoulder after large masses requiring bone and soft tissue resection also brings technical difficulties. Although various surgical procedures have been tried from past to present, in recent years, reconstruction with anatomical mega endoprostheses after resection has become almost a routine. However, in cases where the muscle structures required for the prosthesis to sustain functionally must be removed along with the mass, these prostheses act as spacers and the functional results of the patients are mostly poor. The biomechanical advantages of the reverse shoulder prosthesis, which is routinely applied in rotator cuff arthropathies in elderly patients, have recently become widespread in its use after oncological surgeries.
There is no consensus yet regarding the indications or contraindications for reverse shoulder prosthesis, which is still new to use in oncological shoulder surgeries and has insufficient long-term results. In this article, issues such as the use of reverse shoulder prosthesis after proximal humerus masses, points to be considered in surgery, and comparison with other reconstruction options will be discussed in the light of literature data. Key words: shoulder; reverse shoulder prosthesis; tumor; reconstruction
Proksimal humerus hem primer hem de sekonder malignitelerin sık görüldüğü bir bölgedir.[1] Damar ve sinir paketinin cerrahi alana çok yakın olması bu bölgedeki rezeksiyon planlamalarının ayrıntılı bir şekilde yapılmasını mecbur kılar. Ayrıca glenohumeral eklemin instabiliteye yatkın kompleks yapısı, bu bölgenin uzuv koruyucu cerrahilerindeki teknik zorluğu da beraberinde getirmektedir.[2] Küretaj ve plakla rekonstrüksiyon yapılan hastaların omuz fonksiyonlarında belirgin bir kayıp olmamaktadır. Diğer taraftan aksiller sinir, deltoid kası, rotator manşet, omuz kapsülü gibi yapıları içeren geniş rezeksiyon gerektiren kötü huylu kitlelerde ekstremite fonksiyonlarını korumak zorlaşmaktadır.[3]
Geçmiş yıllarda tümörün başarılı rezeksiyonu sonrası dirsek ve el bileği fonksiyonlarına izin veren stabil bir omza sahip olmak yeterli görülmekteydi.[4] Ancak hasta beklentilerinin değişmesiyle omuz fonksiyonlarını da korumaya yönelik cerrahilere yönelim artmıştır. Bu hastalarda tümörün boyutuna ve invaze ettiği anatomik yapılara göre allogreftle artrodez, fibula otogreftiyle artrodez, klavikula pro humeri rekonstrüksiyon, osteoartiküler allogreft, protez ve allogreft-protez kompozit gibi cerrahi teknikler tanımlanmıştır.[2,5-8] Kısa-orta dönemde kabul edilebilir sonuçlar olmasına rağmen her cerrahi prosedürle alakalı kısıtlılıklar mevcuttur.[3] Protez ile rekonstrüksiyon yapılan hastalar incelendiğinde enfeksiyon, implant gevşemesi, instabilite ve periprostetik kırıklar klinikte en sık karşılaşılan problemleri oluşturmaktadır.[9] Protezin allogreft-kompozitle uygulandığı tekniklerde ise greft-kemik sahasında kaynamama ve greftin lizisi bu cerrahilerin majör komplikasyonlarıdır.[10]
TERS OMUZ PROTEZİ NE ZAMAN TERCİH EDİLMELİ?
Rekonstrüksiyonda hangi metodun ne zaman kullanılması gerektiğiyle ilgili fikir birliği bulunmamaktadır. Erken rehabilitasyona izin vermesi, ameliyat esnasında ekstremite boyunu dengeleme konusundaki esnekliği, tahmin edilebilir sonuçları sebebiyle uzun yıllardır tümör protezleri bu amaçla kullanılmaktaydı.[11] Ancak temiz cerrahi sınır elde etmek amacıyla yapılan geniş yumuşak doku rezeksiyonları dinamik ve statik stabilizatörlerin dengesini bozmaktadır. Bu durum çoğunlukla instabilite veya protezin antero-superior çıkığına neden olmaktadır (Şekil 1).[12] Eski çalışmalara bakıldığında anatomik protezlerden sonra %56-76 oranlarında superior migrasyon gösterilmiştir.[13] İlerleyen teknolojiyle bu oranlarda azalma görülse de takip süresi arttıkça %30 gibi yüksek oranlarda superior migrasyon bu hastalarda karşımıza çıkmaktadır.[13] Dolayısıyla anatomik protez uygulanan hastalarda bu durum kaçınılmaz olarak görülmekte ve yıllar ilerledikçe protez sağkalım oranları azalmaktadır.[14] Sonuç olarak anatomik protezlerin fonksiyonel sonuçlarının tatmin edici seviyede olmaması, onkolojik cerrahide bir alternatif olarak ters omuz protezi kullanımına doğru bir yönelim oluşturmuştur.[15]
Ters omuz protezinin nispeten yeni bir teknik olması sebebiyle onkolojik cerrahi sonrası rekontrüksiyonda kullanımıyla ilgili henüz net sınırlar bulunmamaktadır. Bu implantın temel endikasyonları rotator manşet yetmezliği sonrası oluşan artropatiler ve yaşlı hastalardaki parçalı proksimal humerus kırıklarıdır. Omuz rotasyon merkezini distalize ve medialize ederek deltoid kasına biyomekanik avantaj sağlaması ve anatomik protezlere göre daha stabil bir eklem oluşturması en önemli avantajlarıdır.[16] Geniş rezeksiyon gerektiren kitlelerden sonra oluşan yumuşak doku defektlerinin de instabiliteye
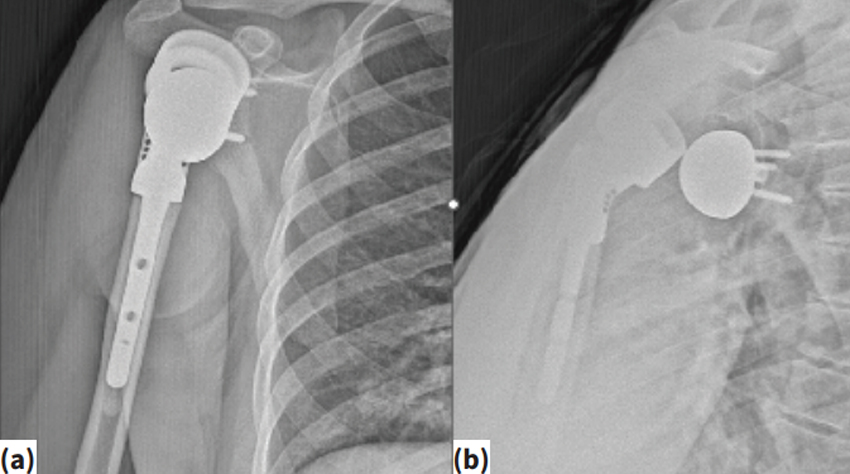
Şekil 1.a.b. Proksimal humerus kondrosarkom rezeksiyon sonrası ters omuz protezi (a), uygulanan hastada ameliyat sonrası dönemdeki ters omuz protez çıkığı (b).
yatkınlığı arttırdığı göz önüne alındığında; son dönemlerde ters omuz protezi onkolojik cerrahilerde popülarite kazanmaya başlamıştır.
Buradaki en önemli husus aksiller sinirin korunmasıdır. Protezin çalışma prensibi deltoid kasına bağlı olduğu için sağlam bir aksiller sinir ameliyat sonrası iyi fonksiyonlar açısından kritiktir.[17] Ancak aksiller sinirin korunamadığı durumlar kesin bir kontrendikasyon oluşturmamaktadır. Rezeksiyonun deltoid kasını da içerdiği durumlarda, orta ve arka deltoidin korunmasının fonksiyonel olarak yeterli olduğu, anterior rezeksiyonun sonuçları etkilemediği gösterilmiştir (Şekil 2).[18] Deltoid kasının insersiyosunun distalinden yapılan rezeksiyonlar ters omuz protezi açısından kontrendikasyon olmamakla beraber; bu hastalarda kemik allogreft kullanımı gerekmektedir.[19] Bununla birlikte glenoidde ciddi kemik defekti oluşturan kitlelerde de ters omuz protezi doğru bir seçenek olmayabilir.[3]
Şekil 2. Deltoid kasının humerus şaftına yapışan posterior liflerinin korunması.
FONKSİYONEL SONUÇLARI ETKİLEYEN DURUMLAR
Aksiller Sinir Ters omuz protezinin çalışma prensibi düşünüldüğünde rezeksiyon sırasında aksiller sinirin korunması cerrahi sonrası omuz fonksiyonları açısından kritiktir. Deltoid kasının fonksiyonel durumu hastaların cerrahi sonrasındaki omuz hareketlerini belirlemede temel unsuru oluşturmaktadır. Aksiller sinirin hasar gördüğü durumlarda fonksiyonel kapasite azalmakla beraber, yeterli kas tonusunun olmaması stabiliteyi de olumsuz yönde etkilemektedir. Yapılan bir çalışmada rotator manşet artropatisi sonrası yapılan ters omuz protezi cerrahisinde instabilitenin en büyük sebebinin aksiller sinir ve deltoid disfonksiyonu olduğu gösterilmiştir.[20]
Temiz cerrahi sınırın en önemli amaç olduğu geniş rezeksiyonlarda aksiller siniri korumak her zaman mümkün olmamaktadır. Bazı durumlarda sinirin tamamen veya parsiyel olarak rezeksiyonu gerekmektedir. Ancak literatüre bakıldığında tümör cerrahileri sonrası yapılan ters omuz protezlerinde aksiller sinirin sağlamlığı ile fonksiyonel sonuçlar arasında kesin bir korelasyon yoktur. Streitbuerger ve ark.’nın 18 vakalık serilerinde, aksiller siniri rezeke edilen dört hastanın omuz abdüksiyon, elevasyon ve rotasyon açıklıkları aksiller siniri korunan hastalara göre daha düşük seviyede çıkmıştır.[21] Ancak bu farkın istatistiksel olarak anlamsız olduğu gösterilmiştir. Griffiths ve ark. yaptıkları çalışmada aksiller sinirin korunduğu ve rezeke edildiği gruplar arasında fonksiyonel olarak anlamlı fark olmadığını göstermişlerdir.[22]
Yumuşak Doku Rekonstrüksiyonu
Proksimal humerus omuz fonksiyon ve stabilitesine katkıda bulunan birçok yapının orjin aldığı veya sonlandığı bir bölgedir. Mevcut kitlenin rezeksiyonu sonrası yerinden kaldırılan yumuşak dokuların tekrar anatomik yerlerine tespiti rutin bir uygulamadır. Rezeksiyon miktarı distale doğru ilerledikçe deltoid, latissimus dorsi, teres majör gibi kaslar da bu durumdan etkilenmektedir. Bu hastalarda kullanılan rekonstrüksiyon tipine göre tespit direkt protez üzerine veya allogrefte yapılabilmektedir. Protezle rekonstrüksiyon yapılan vakalarda yumuşak dokuların tespitini kolaylaştırmak ve daha biyolojik bir iyileşme amacıyla protez etrafına tübüler prolen mesh örtüsü de zaman zaman kullanılmaktadır (Şekil 3).[21,23] Yumuşak doku komponenti içermeyen kitlelerde bahsedilen bu yapıların tamamı korunabilmekte ve tekrar tespitleri mümkün olmaktadır. Ancak kitlenin içerdiği yumuşak doku komponenti büyüdükçe cerrahi sonrası fonksiyonlar için kritik olan kas kütlesi azalmaktadır. Kemik rezeksiyon miktarının büyüklüğünden ziyade zarar gören yumuşak dokular daha önemli gözükmektedir.
Şekil 3.a,b. Ters omuz tümör protezine yumuşak doku tespiti için prolen-mesh kullanımı (a,b).
Bu durumla ilgili olarak Streitbuerger ve ark., ters omuz proteziyle rekonstrüksiyon yaptıkları hastalarda; yumuşak doku komponenti içermeyen grubun cerrahi sonrası hem fonksiyonel hem de ağrı olarak daha iyi durumda olduklarını göstermişlerdir.[21]
Her ne kadar kasların cerrahi sonrasında tekrar fonksiyonel hâle gelmesi amacıyla tespit rutin bir uygulama olsa da literatür incelendiğinde onkolojik cerrahilerde yumuşak dokuların tespitinin omuz fonksiyonlarına katkısı tartışmalıdır. Bonnevialle ve ark.’nın 10 hastalık serisinde deltoidin kaldırılıp tekrar tespit edildiği grupla, deltoidin tamamen korunduğu grup arasında klinik skorlar ve omuz eklem hareket açıklığı açısından anlamlı fark saptanmamıştır.[19] Benzer şekilde deltoid kasının parsiyel rezeksiyon yapıldığı ve sağlam bırakıldığı iki grup hem klinik skorlar hem de fonksiyonel sonuçlar açısından benzer çıkmışlardır.[24] On üç hastalık bir başka seride de yumuşak doku tamiriyle öne fleksiyon arasında ilişki saptanmamıştır.[25]
Hastaların büyük bir bölümünde rotator manşet de kitleyle rezeke edilmekte, özellikle postero-superior rotator manşetin rezeksiyonu dış rotasyonda hem kısıtlılık hem de zayıflık oluşturmaktadır. Bu hastalarda Boileau ve ark. tarafından modifiye edilen L’Episcopo prosedürü, ameliyat sonrası dış rotasyon hareketini kazanmak açısından önemlidir.[26] Bu teknikte latissimus dorsi ve ters majör tendonları humerusun posteriorundan geçirilerek, kullanılan rekonstrüksiyon tipine göre proteze ya da allogreft üzerindeki yumuşak dokulara tespit edilir. De Wilde ve ark. dokuz hastalık serilerinde, iki hastada teres omuz proteziyle beraber latissimus dorsi ve teres majör transferi uygulamışlardır.[27] Son takiplerde yapılan muayenelerde bu hastalarda ortalama 60° olan dış rotasyon, tendon transferi yapılmayan hasta grubunda ortalama 17° olarak bulunmuştur. Tendon transferi yapılmayan hastalardaki ortalama abdüksiyon derecesi bir miktar az görünse de bu fark klinik olarak anlamsız saptanmıştır.
Kemik Rezeksiyon Miktarı
Proksimal humerusta kemik rezeksiyon miktarı cerrahi tekniği etkileyen önemli bir faktördür. Yapılan kemik rezeksiyonu miktarını belirtmek amacıyla Malawer ve Enneking’in tanımlamış oldukları iki ayrı sınıflama sistemi kullanılmaktadır.[28,29] Rezeksiyonun distale ilerlemesi hastada bulunan kemik stokunu azaltmakta ve yapılan cerrahiyi teknik olarak daha zorlu hâle getirmektedir. Kemikten kaldırılan kas miktarı arttıkça; rekonstrüksiyon sonrası daha kompleks yumuşak doku tespit ihtiyacı doğmakta, bunun da fonksiyonel sonuçları kötü etkileyeceği düşünülmektedir. Ancak 2021 yılında yapılan sistematik bir değerlendirmede, rezeksiyon miktarıyla cerrahi sonrası hasta fonksiyonları arasında bir ilişki gösterilmemiştir.[3]
ALLOGREFT-PROTEZ KOMPOZİT İLE TERS OMUZ PROTEZİ
Kemik rezeksiyonunun fazla miktarda yapıldığı hastalarda, proksimalde oluşan kemik defektini rekonstrükte etmek amacıyla uzun yıllardır masif tümör protezleri kullanılmaktaydı. Periprostetik kırık ve aseptik gevşeme gibi komplikasyonların sık olarak ortaya çıkmasıyla beraber farklı tekniklere ihtiyaç doğmuştur. Son dönemlerde allogreft-protez kompozit ile protez uygulaması bu hastalarda başarılı bir alternatif olarak uygulanmaktadır.
Allogreft-protez kompozitle omuz protezi uygulaması için ilk basamak, hastanın kemik çapıyla uyumlu bir allogreftin bulunmasıdır. Allogreftin üstündeki kapsül ve tendon yapıları daha sonraki tamir için sütürlerle işaretlenir. Rezeke edilen kemik uzunluğu kadar greft osteotomize edilerek rekonstrüksiyon için hazır hâle getirilir. Allogreft-kemik kaynama sahası için sadece uzun stem kullanılan veya plakla tespit yapılan farklı cerrahi teknikler mevcut olup bunların birbirine herhangi bir üstünlüğü gösterilememiştir.[10,19,30] Her iki teknikte de allogreft-kemik kaynama sahasına çimento girmemesine dikkat edilmelidir.
Bu tekniğin anatomik tümör protezine göre birkaç mekanik avantajı mevcuttur. Kemik stoku sağlayarak deltoidin sarma efektini arttırır. Aynı zamanda humerus üstündeki mekanik stresi dağıtarak kemik stoku ve implant stabilitesini korur.[31] Masif protezlerde tendon tespiti mecburen metal üzerine yapılmakta ve iyileşme gerçekleşmemektedir. Bunun sonucunda da instabilite ve antero-superior çıkıklar oluşmaktadır. Allogreft kullanıldığında ise eklem kapsülü, deltoid, rotator manşet, pektoralis majör ve latissimus dorsi gibi yapılar allogrefte direkt tespit edilebilmekte ve gerçek bir yumuşak doku iyileşmesi elde edilmektedir.[32] Pektoralis majör tendonunun allogrefte tespit edilerek tamir edilmesinin adduktor kontraktürüne sebep olabilmesi sebebiyle bu tamirin önerilmediği teknikler de mevcuttur.[8] Bu teknikte en sık karşılaşılan komplikasyonlar ise allogreftin osteolizi, instabilite ve greft-kemik hattında kaynamamadır.[10]
REZEKSİYON SONRASI PROTEZ SEÇENEKLERİ
Ters omuz protezinin diğer rekonstrüksiyon teknikleriyle direkt olarak karşılaştırıldığı çalışmalar çok kısıtlıdır. Çoğunlukla kısıtlı vaka serilerini içeren çalışmalara bakıldığında genel olarak hastalar ameliyat sonrası eklem hareket açıklıkları, ağrı ve instabilite üzerinden değerlendirilmiştir. Rekonstrüksiyon olarak anatomik protezlerin kullanıldığı çalışmalarda öne fleksiyon dereceleri ortalama olarak Zuo ve ark. tarafından 50,6°, Grosel ve ark. tarafından 28°, Cannon ve ark. tarafından 42° olarak bulunmuştur.[13,33,34] Ters omuz protezi kullanılan vaka serilerine bakıldığında ise hastaların 100°, 85°, 95°, 71° gibi belirgin olarak daha iyi aktif omuz eklem hareket açıklığına sahip olduğu görülmektedir.[23,24,33,34] Hatta aksiller sinirin tamamen ya da parsiyel olarak hasar görmesine rağmen ters omuz protezi uygulanan hastalardaki omuz hareketleri, aksiller siniri korunmuş hemiartroplasti hastalarına göre bile iyi durumdadır.[21]
Grosel ve ark. yaptıkları çalışmada, ters omuz protezi uygulanan hasta grubundaki fonksiyonel sonuçların parsiyel protez uygulanan hastalara göre daha iyi olduğunu göstermişlerdir.[34] Hemiartroplasti uygulanan altı hastada cerrahi sonrası dönemde instabilite saptanırken, ters omuz protezi grubunda takip sürecinde subluksasyon veya dislokasyonla karşılaşılmamıştır.
Allogreft ya da otogreft prostetik-kompozit tekniğiyle ters omuz protezi ve hemiartroplasti sonrası üç yıllık takiplerin olduğu bir çalışmada, fonksiyonel sonuçlarla beraber ağrı durumunun da ters omuz protezi grubunda anlamlı olarak daha iyi olduğu gösterilmiştir.[33] Ayrıca ameliyat sonrası birinci yıldan itibaren hemiartroplasti hasta grubunda fonksiyonel skorların kötüleşme eğiliminde olduğu ancak ters omuz protezi yapılan hastaların stabil seyrettiği belirtilmiştir. Bununla birlikte komplikasyon, revizyon ihtiyacı ve instabilite açısından iki grup da benzer seyretmiştir.
Rekonstrüksiyon tercihi olarak allogreft-kompozit protezler tercih edildiğinde, ters omuz protezinin belirgin olan üstünlüğünün ortadan kalktığı görülmektedir. Han ve ark.’nın, allogreft protez-kompozit tekniğiyle parsiyel omuz protezi ve ters omuz protezini karşılaştırdıkları çalışmada her iki grup da fonksiyonel skorlar, ağrı skorları ve komplikasyonlar açısından benzer çıkmışlardır.[36] Literatürdeki karşılaştırmalı diğer çalışmalardan farklı olarak burada kullanılan allogreft, hastada kalan yumuşak dokuların rekonstrüksiyonunun daha biyolojik bir biçimde yapılmasına olanak sağlamış ve fonksiyonel sonuçları da olumlu yönde değiştirmiştir. Dolayısıyla glenoid tutulumu olmayan genç hasta grubunda, daha sonraki revizyon cerrahisi de düşünülerek allogreft-kompozitle parsiyel protez seçeneğini değerlendirmek daha uygun olacaktır.
KAYNAKLAR
- Dahlin DC. Bone tumors: General aspects and data on 6221 cases. 3rd ed. Springfield: Thomas CC; 1978.
- Rödl RW, Gosheger G, Gebert C, Lindner N, Ozaki T, Winkelmann W. Reconstruction of the proximal humerus after wide resection of tumours. J Bone Joint Surg Br. 2002;84(7):1004-8. [Crossref]
- Ferlauto HR, Wickman JR, Lazarides AL, Hendren S, Visgauss JD, Brigman BE, et al. Reverse total shoulder arthroplasty for oncologic reconstruction of the proximal humerus: A systematic review. J Shoulder Elbow Surg. 2021;30(11):e647-e58. [Crossref]
- O'Connor MI, Sim FH, Chao EY. Limb salvage for neoplasms of the shoulder girdle. Intermediate reconstructive and functional results. J Bone Joint Surg Am. 1996;78(12):1872-88. [Crossref]
- Bilgin SS. Reconstruction of proximal humeral defects with shoulder arthrodesis using free vascularized fibular graft. J Bone Joint Surg Am. 2012;94(13):e94. [Crossref]
- Winkelmann WW. Clavicula pro humero--a new surgical method for malignant tumors of the proximal humerus. Z Orthop Ihre Grenzgeb. 1992;130(3):197-201. [Crossref]
- Asavamongkolkul A, Eckardt JJ, Eilber FR, Dorey FJ, Ward WG, Kelly CM, et al. Endoprosthetic reconstruction for malignant upper extremity tumors. Clin Orthop Relat Res. 1999;(360):207-20. [Crossref]
- Abdeen A, Healey JH. Allograft-prosthesis composite reconstruction of the proximal part of the humerus: Surgical technique. J Bone Joint Surg Am. 2010;92(1 Pt 2):188-96. [Crossref]
- Shukla D, Lee J, Mangold D, Cofield R, Sanchez-Sotelo J, Sperling J. Reverse shoulder arthroplasty with proximal humeral replacement for the management of massive proximal humeral bone loss. J Shoulder Elb Arthroplast. 2018;2:247154921877984. [Crossref]
- King JJ, Nystrom LM, Reimer NB, Gibbs CP Jr., Scarborough MT, Wright TW. Allograft-prosthetic composite reverse total shoulder arthroplasty for reconstruction of proximal humerus tumor resections. J Shoulder Elbow Surg. 2016;25(1):45-54. [Crossref]
- Tiwari A. Current concepts in surgical treatment of osteosarcoma. J Clin Orthop Trauma. 2012;3(1):4-9. [Crossref]
- Farshad M, Gerber C. Reverse total shoulder arthroplasty-from the most to the least common complication. Int Orthop. 2010;34(8):1075-82. [Crossref]
- Cannon CP, Paraliticci GU, Lin PP, Lewis VO, Yasko AW. Functional outcome following endoprosthetic reconstruction of the proximal humerus. J Shoulder Elbow Surg. 2009;18(5):705-10. [Crossref]
- Mayilvahanan N, Paraskumar M, Sivaseelam A, Natarajan S. Custom mega-prosthetic replacement for proximal humeral tumours. Int Orthop. 2006;30(3):158-62. [Crossref]
- De Wilde LF, Van Ovost E, Uyttendaele D, Verdonk R. Results of an inverted shoulder prosthesis after resection for tumor of the proximal humerus. Rev Chir Orthop Reparatrice Appar Mot. 2002;88(4):373-8.
- Boileau P, Watkinson D, Hatzidakis AM, Hovorka I. Neer award 2005: The Grammont reverse shoulder prosthesis: Results in cuff tear arthritis, fracture sequelae, and revision arthroplasty. J Shoulder Elbow Surg. 2006;15(5):527-40. [Crossref]
- Flatow EL, Harrison AK. A history of reverse total shoulder arthroplasty. Clin Orthop Relat Res. 2011;469(9):2432-9. [Crossref]
- Lädermann A, Walch G, Denard PJ, Collin P, Sirveaux F, Favard L, et al. Reverse shoulder arthroplasty in patients with pre-operative impairment of the deltoid muscle. Bone Joint J. 2013;95-B(8):1106-13. [Crossref]
- Bonnevialle N, Mansat P, Lebon J, Laffosse JM, Bonnevialle P. Reverse shoulder arthroplasty for malignant tumors of proximal humerus. J Shoulder Elbow Surg. 2015;24(1):36-44. [Crossref]
- Kohan EM, Chalmers PN, Salazar D, Keener JD, Yamaguchi K, Chamberlain AM. Dislocation following reverse total shoulder arthroplasty. J Shoulder Elbow Surg. 2017;26(7):1238-45. [Crossref]
- Streitbuerger A, Henrichs M, Gosheger G, Ahrens H, Nottrott M, Guder W, et al. Improvement of the shoulder function after large segment resection of the proximal humerus with the use of an inverse tumour prosthesis. Int Orthop. 2015;39(2):355-61. [Crossref]
- Griffiths D, Gikas PD, Jowett C, Bayliss L, Aston W, Skinner J, et al. Proximal humeral replacement using a fixed-fulcrum endoprosthesis. J Bone Joint Surg Br. 2011;93(3):399-403. [Crossref]
- Maclean S, Malik SS, Evans S, Gregory J, Jeys L. Reverse shoulder endoprosthesis for pathologic lesions of the proximal humerus: A minimum 3-year follow-up. J Shoulder Elbow Surg. 2017;26(11):1990-4. [Crossref]
- Lazerges C, Dagneaux L, Degeorge B, Tardy N, Coulet B, Chammas M. Composite reverse shoulder arthroplasty can provide good function and quality of life in cases of malignant tumour of the proximal humerus. Int Orthop. 2017;41(12):2619-25. [Crossref]
- Mengers SR, Knapik DM, Strony J, Nelson G, Faxon E, Renko N, et al. The use of tumor prostheses for primary or revision reverse total shoulder arthroplasty with proximal humeral bone loss. J Shoulder Elb Arthroplast. 2022;6:24715492211063108. [Crossref]
- Boileau P, Chuinard C, Roussanne Y, Bicknell RT, Rochet N, Trojani C. Reverse shoulder arthroplasty combined with a modified latissimus dorsi and teres major tendon transfer for shoulder pseudoparalysis associated with dropping arm. Clin Orthop Relat Res. 2008;466(3):584-93. [Crossref]
- De Wilde L, Boileau P, Van der Bracht H. Does reverse shoulder arthroplasty for tumors of the proximal humerus reduce impairment? Clin Orthop Relat Res. 2011;469(9):2489-95. [Crossref]
- Malawer MM, Meller I, Dunham WK. A new surgical classification system for shoulder-girdle resections: Analysis of 38 patients. Clin Orthop Relat Res. 1991;(267):33-44. [Crossref]
- Enneking W, Dunham W, Gebhardt M, Malawar M, Pritchard D. A system for the classification of skeletal resections. Chir Organi Mov. 1990;75(1 Suppl):217-40.
- Sanchez-Sotelo J, Wagner ER, Sim FH, Houdek MT. Allograft-prosthetic composite reconstruction for massive proximal humeral bone loss in reverse shoulder arthroplasty. J Bone Joint Surg Am. 2017;99(24):2069-76. [Crossref]
- Callamand G, Barret H, Saint-Genez F, Bonnevialle P, Mansat P, Bonnevialle N. Reconstruction by allograft-prosthetic composite reverse shoulder arthroplasty after proximal humerus tumor resection: Clinical and radiographic assessment at a minimum 2 years' follow-up. Orthop Traumatol Surg Res. 2022;108(4):102957. [Crossref]
- Sirveaux F. Reconstruction techniques after proximal humerus tumour resection. Orthop Traumatol Surg Res. 2019;105(1 Suppl):S153-S164. [Crossref]
- Zuo D, Mu H, Yang Q, Sun M, Shen J, Wang H, et al. Do reverse total shoulder replacements have better clinical and functional outcomes than hemiarthroplasty for patients undergoing proximal humeral tumor resection using devitalized autograft composite reconstruction: A case-control study. J Orthop Surg Res. 2021;16(1):453. [Crossref]
- Grosel TW, Plummer DR, Everhart JS, Kirven JC, Ziegler CL, Mayerson JL, et al. Reverse total shoulder arthroplasty provides stability and better function than hemiarthroplasty following resection of proximal humerus tumors. J Shoulder Elbow Surg. 2019;28(11):2147-52. [Crossref]
- Houdek MT, Bukowski BR, Athey AG, Elhassan BT, Barlow JD, Morrey ME, et al. Comparison of reconstructive techniques following oncologic intraarticular resection of proximal humerus. J Surg Oncol. 2021;123(1):133-40. [Crossref]
- Han J, Kim WL, Kim Y, Cho HS, Oh JH. Does reverse total shoulder arthroplasty with allograft-prosthesis composite (APC) have surgical benefits over hemiarthroplasty with APC in patients with tumors of the proximal humerus? Jpn J Clin Oncol. 2022;52(12):1408-15. [Crossref]
 لغة
لغة Türkçe
Türkçe English
English Arabic
Arabic Germany
Germany Russian
Russian